技術
免疫新知
人體的免疫系統是由免疫細胞、免疫組織及免疫器官所組成的,能保護身體抵抗外來病原體的感染或辨認出體內不正常的細胞加以摧毀。
免疫細胞
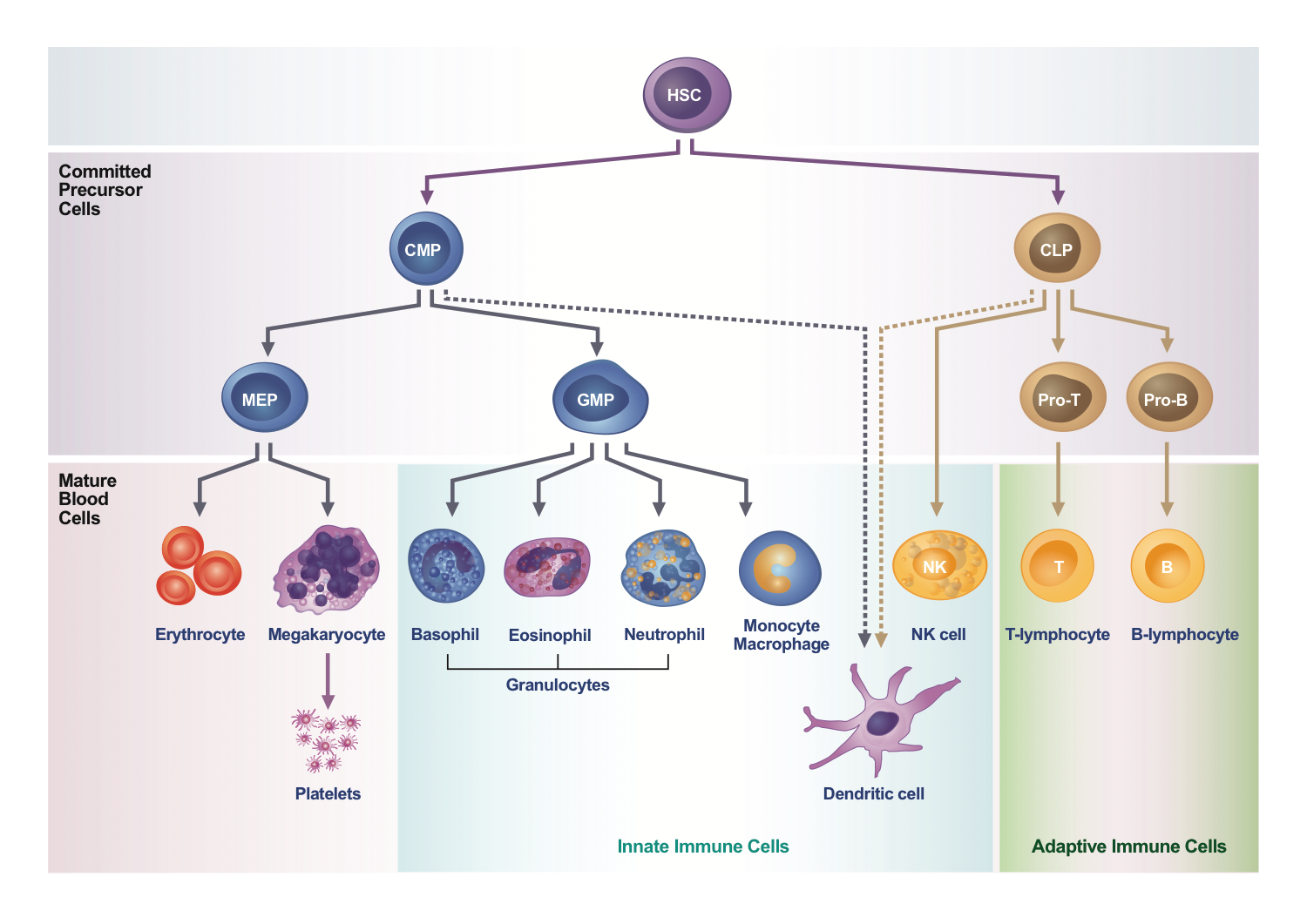 免疫細胞分為先天性免疫細胞及後天性免疫細胞。先天性免疫細胞包含有顆粒性白血球、肥大細胞、單核 白血球、樹突細胞,以及自然殺手細胞。當辨認到外來病原體或不正常細胞時,先天性免疫細胞會馬上產 生非抗原專一性的免疫反應,吞噬病原體或攻擊不正常細胞,並透過分泌細胞激素或抗原呈現能力來進一 步活化後天性免疫細胞。後天性免疫細胞則包含有T細胞及B細胞,這些細胞被活化後會大量增生,產生具有抗原專一性的免疫保護力,並有進一步的產生免疫記憶力的功能。
免疫細胞分為先天性免疫細胞及後天性免疫細胞。先天性免疫細胞包含有顆粒性白血球、肥大細胞、單核 白血球、樹突細胞,以及自然殺手細胞。當辨認到外來病原體或不正常細胞時,先天性免疫細胞會馬上產 生非抗原專一性的免疫反應,吞噬病原體或攻擊不正常細胞,並透過分泌細胞激素或抗原呈現能力來進一 步活化後天性免疫細胞。後天性免疫細胞則包含有T細胞及B細胞,這些細胞被活化後會大量增生,產生具有抗原專一性的免疫保護力,並有進一步的產生免疫記憶力的功能。
免疫細胞療法
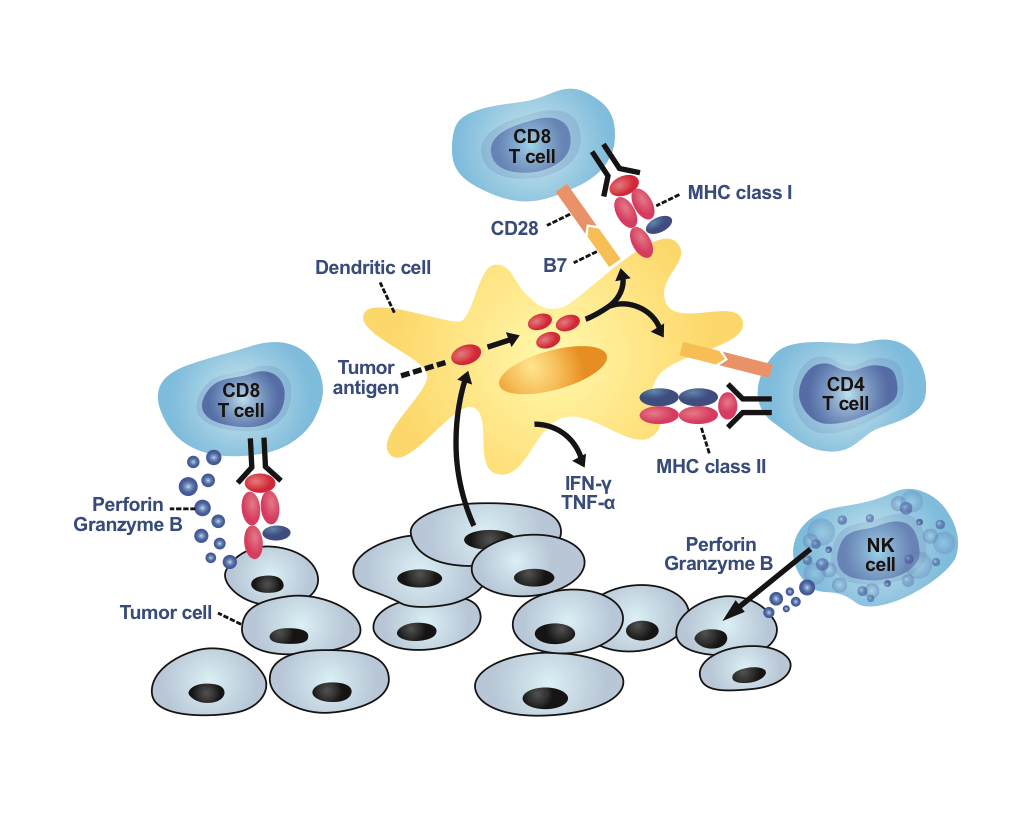 傳統治療癌症病人的方式是使用手術、化療或放射療法,這些療法已證明能夠清除病人體內的癌細胞或舒 緩病人的病情。然而當體內還有少量殘存的癌細胞或產生抗藥性的癌細胞時,還是會導致癌症的復發,所 以科學家們仍繼續致力於研究出更有效的癌症治療方法。免疫細胞療法使用免疫細胞去攻擊清除癌症細胞 ,是一種溫和的輔助療法,能夠與傳統癌症療法並行,清除體內殘存的癌細胞,預防癌細胞的復發,以達 到更好的療效。臨床研究上,最常用於免疫細胞療法的細胞種類有自然殺手細胞,樹突細胞及T細胞。
傳統治療癌症病人的方式是使用手術、化療或放射療法,這些療法已證明能夠清除病人體內的癌細胞或舒 緩病人的病情。然而當體內還有少量殘存的癌細胞或產生抗藥性的癌細胞時,還是會導致癌症的復發,所 以科學家們仍繼續致力於研究出更有效的癌症治療方法。免疫細胞療法使用免疫細胞去攻擊清除癌症細胞 ,是一種溫和的輔助療法,能夠與傳統癌症療法並行,清除體內殘存的癌細胞,預防癌細胞的復發,以達 到更好的療效。臨床研究上,最常用於免疫細胞療法的細胞種類有自然殺手細胞,樹突細胞及T細胞。
- 自然殺手細胞:自然殺手細胞為先天性免疫細胞成員,能辨認出體內異常的細胞(如癌症細胞或病毒感染的細胞),透過釋出化學物質、抗體依賴型細胞介導的細胞毒性作用,以及表現表面毒殺性 蛋白質來直接毒殺異常細胞。
- 樹突細胞:樹突狀細胞為一種抗原呈現細胞,會吞噬凋亡的癌症細胞,將癌症細胞分解成小片段抗原呈現給T細胞,在活化具抗癌專一性T細胞的過程中扮演重要角色。
- T細胞:T細胞為具抗原專一性的後天性免疫細胞,分為毒殺型、輔助型以及調節型T細胞。其中以毒殺型T細胞為清除癌症細胞較有效的細胞型態,能經由表現表面毒殺性蛋白質及釋出化學物質,攻擊癌症細胞。
細胞輸入療法
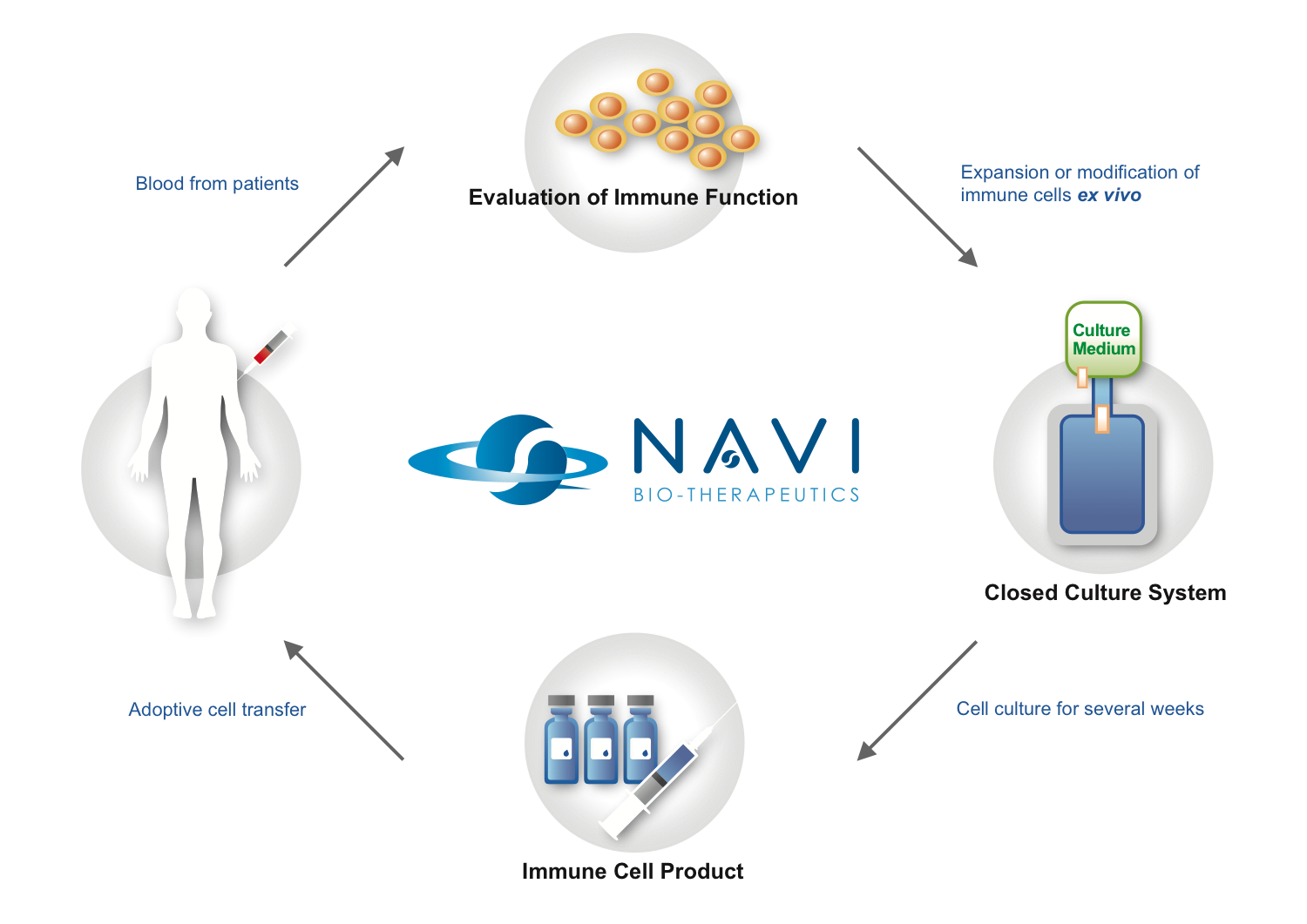 細胞輸入療法是將取自病人體內的免疫細胞在體外培養活化或進行基因改造後,增加其辨認及毒殺癌細胞 能力,再將這些細胞打回病人體內來治療癌症。臨床試驗中有多種免疫細胞回輸療法應用在治療癌症上, 包括腫瘤浸潤性淋巴細胞、毒殺性T細胞、自然殺手細胞、樹突細胞、淋巴激素活化殺手細胞、細胞激素 誘導殺手細胞、T細胞受體或嵌合抗原受體重組T細胞。目前已有許多臨床試驗證明細胞回輸療法是可行並 有療效的。我們公司將致力於發展體外免疫細胞的培養技術,並提供相關產業技術服務。
細胞輸入療法是將取自病人體內的免疫細胞在體外培養活化或進行基因改造後,增加其辨認及毒殺癌細胞 能力,再將這些細胞打回病人體內來治療癌症。臨床試驗中有多種免疫細胞回輸療法應用在治療癌症上, 包括腫瘤浸潤性淋巴細胞、毒殺性T細胞、自然殺手細胞、樹突細胞、淋巴激素活化殺手細胞、細胞激素 誘導殺手細胞、T細胞受體或嵌合抗原受體重組T細胞。目前已有許多臨床試驗證明細胞回輸療法是可行並 有療效的。我們公司將致力於發展體外免疫細胞的培養技術,並提供相關產業技術服務。
研發方向
 納維再生科技擁有免疫細胞的體外培養技術,並致力於發展多種針對治療癌症的自體免疫細胞療法。
納維再生科技擁有免疫細胞的體外培養技術,並致力於發展多種針對治療癌症的自體免疫細胞療法。
- 自體免疫細胞療法:納維再生科技預計於2016年與台大醫院合作進行體外培養自體自然殺手細胞的臨床試驗。在體外短時間內大量繁殖及活化患者本身的自然殺手細胞,再將活化的自然殺手細胞打回體內清除化療後殘餘的癌症細胞,希望藉此能提高癌症病患的整體存活率及無惡化存活時間,並改善病患的生活品質。
- 自體多重免疫細胞療法:多重免疫細胞療法是未來免疫細胞療法的一種新趨勢,可結合多種免疫細胞的不同功能,如樹突細胞活化後天性免疫反應的能力與自然殺手細胞直接毒殺腫瘤細胞的功能,透過免疫細胞間的互相活化影響,達到啟動體內主動免疫反應的最佳效果。
- 基因修飾免疫細胞:利用基因重組方式,讓T細胞或NK細胞帶有嵌合抗原受體(ChimericAntigen Receptor,CAR)。嵌合抗原受體是由具癌細胞專一性的單鏈抗體(single chain variable fragment, scFv)、CD3蛋白zeta鏈及共同刺激分子(如CD28, 41BB)崁合而成。當單鏈抗體與癌細胞的抗原 結合,此嵌合抗原受體會釋放活化訊號,促進T細胞或NK細胞活化,進而達到專一性地毒殺癌細 胞的效果。
- 基因療法:siRNA於癌症治療上的應用。
- 全封閉式細胞分離培養技術:細胞製劑的製備,除了要達到細胞的活性之外,同時必須避免污染。全封閉式的細胞培養方式,可以降低細胞污染的風險。
文獻
- Suen, J. L., Chuang, Y. H., Tsai, B. Y., Yau, P. M., & Chiang, B. L. (2004). Treatment of murine lupus using nucleosomal T cell epitopes identified by bone marrow-derived dendritic cells. Arthritis & Rheumatism, 50(11), 3250–3259.
- Tsai, B. Y., Lin, Y. L., & Chiang, B. L. (2009). Application of interleukin-12 expressing dendritic cells for the treatment of animal models of leukemia. Experimental Biology and Medicine (Maywood), 234(8), 952–960.
- Tsai, B. Y., Lin, Y. L., & Chiang, B. L. (2010). Autoimmune response induced by dendritic cells exerts anti-tumor effect in murine model of leukemia. Journal of Autoimmunity, 34(4), 364–370.
- Tsai, B. Y., Suen, J. L., & Chiang, B. L. (2010). Lentiviral-mediated Foxp3 RNAi suppresses tumor growth of regulatory T cell-like leukemia in a murine tumor model. Gene Therapy, 17(8), 972–979.
- Rosenberg, S. A., & Restifo, N. P. (2015). Adoptive cell transfer as personalized immunotherapy for human cancer. Science, 348(6230), 62–68.
- Schmeel, L. C., Schmeel, F. C., Coch, C., & Schmidt-Wolf, I. G. (2015). Cytokine-induced killer (CIK) cells in cancer immunotherapy: Report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology, 141(5), 839–849.
- Childs, R. W., & Carlsten, M. (2015). Therapeutic approaches to enhance natural killer cell cytotoxicity against cancer: The force awakens. Nature Reviews Drug Discovery, 14(7), 487–498.
- Dahlberg, C. I., Sarhan, D., Chrobok, M., Duru, A. D., & Alici, E. (2015). Natural killer cell-based therapies targeting cancer: Possible strategies to gain and sustain anti-tumor activity. Frontiers in Immunology, 6, 605.